研究成功在体内构建CAR-T细胞
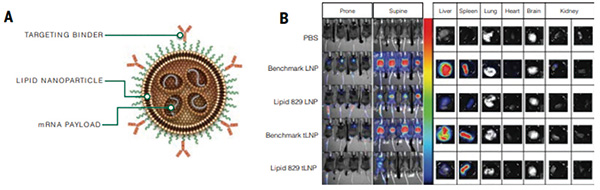
美国研究者Hunter等开发了一种体内CAR-T细胞工程策略,该技术核心是使用靶向脂质纳米颗粒(tLNPs)将信使RNA(mRNA)递送至特定的T细胞亚群,让mRNA来表达特定的CAR。与传统DNA载体不同,mRNA不会整合到宿主基因组中,从而避免了长期遗传改变的风险,提高了治疗的安全性。(Science. 2025, 388: 1311)
研究者设计了一种名为L829的新型可离子化脂质颗粒,它解决了传统脂质纳米颗粒面临的主要挑战——肝脏网状内皮系统的吸收问题。与传统脂质颗粒相比,L829可有效避开肝脏的过滤系统、肝脏吸收率显著减低,并表现出更精确的T细胞递送。
在肝脏减少吸收的优势下,L829能迅速且有效地前往脾脏、骨髓等T细胞聚集的地方。研究者重点关注了CD8+ T细胞亚群的特异性靶向,这类T细胞具有很强的肿瘤杀伤性,因此是优先改造目标。
小鼠实验中,研究者将CD8抗体与L829脂质颗粒结合,让该工具优先在CD8+ T细胞中积累。观察结果显示,CD8-L829-tLNP能在血液、脾脏、骨髓和淋巴结中快速(24小时内)改造CD8+ T细胞。
在确认这一策略有效后,研究者后续给脂质颗粒载体设计了合适的mRNA序列,主要用于表达CD19 CAR。CD19在B细胞恶性肿瘤和自身免疫病中发挥着关键作用,比如急性B淋巴细胞白血病中,超过90%的病例都高度表达CD19。该脂质颗粒载体可有效地帮助CD8+ T细胞产生寻找CD19的“探测器”,在体内构建出靶向CD19的CAR-T细胞。
在普通小鼠模型中,单次注射脂质颗粒6小时后,CD8+ T细胞中的CAR表达即可达到峰值;24小时内,小鼠脾脏中的B细胞被大量清除。在白血病小鼠模型中,研究者待肿瘤细胞生长一定时间后,为小鼠注射了脂质颗粒。研究者发现小鼠每周接受两次治疗,持续2周后,即能显著控制肿瘤生长。剂量更高的实验组中,甚至有小鼠出现了肿瘤完全清除。
研究者在猕猴中重复了验证实验,结果同样显示该策略可以有效诱导B细胞的清除。治疗结束后,B细胞数量会逐渐恢复,不会长期对猕猴的免疫系统造成破坏。提示该策略能在治疗期间有效发挥作用,且具备较高的安全性。
该研究展示的体内CAR-T生成技术,有望帮助简化制造过程、降低成本、提高可及性,使更多患者受益。除了帮助应对肿瘤,新技术还能为自身免疫性疾病患者提供一种变革性的治疗选择,在不需要长期免疫抑制的情况下帮助患者实现疾病缓解。
(编译 张瑞轩)