研究开发新型精装CAR-T疗法
澳大利亚Peter MacCallum癌症中心Chen等,基于CRISPR基因编辑技术,筛选到在肿瘤内特异性启动基因表达的两个启动子,将二者分别与促炎因子基因整合,实现了通过肿瘤内源性调控机制驱动CAR-T基因表达,实现在肿瘤局部精准递送免疫因子的策略,且不会产生明显毒副作用的目的,为提高CAR-T细胞治疗实体瘤的安全性和疗效开辟了蹊径。(Nature. 2025年7月2日在线版)
CAR-T疗法已在血液系统恶性肿瘤治疗中取得成效,但在实体瘤治疗中疗效受制于肿瘤微环境的免疫抑制和肿瘤抗原的高度异质性。为增强CAR-T杀灭肿瘤细胞的能力,研究者曾尝试让CAR-T细胞额外分泌促炎因子如IL-12和IL-2,但传统做法易引发外周毒性,限制临床应用。
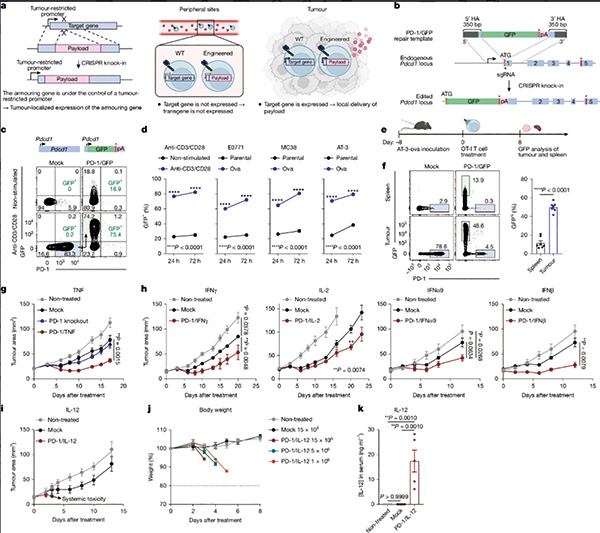
为解决这一难题,研究者创新性设计了CRISPR敲入策略,将细胞因子基因精确插入CAR-T细胞内源性、对肿瘤高度特异的启动子区域。通过系统筛选,研究者发现NR4A2和RGS16启动子可在肿瘤环境中选择性激活,使得可仅在肿瘤部位局部表达所需细胞因子,显著减少外周毒性风险。
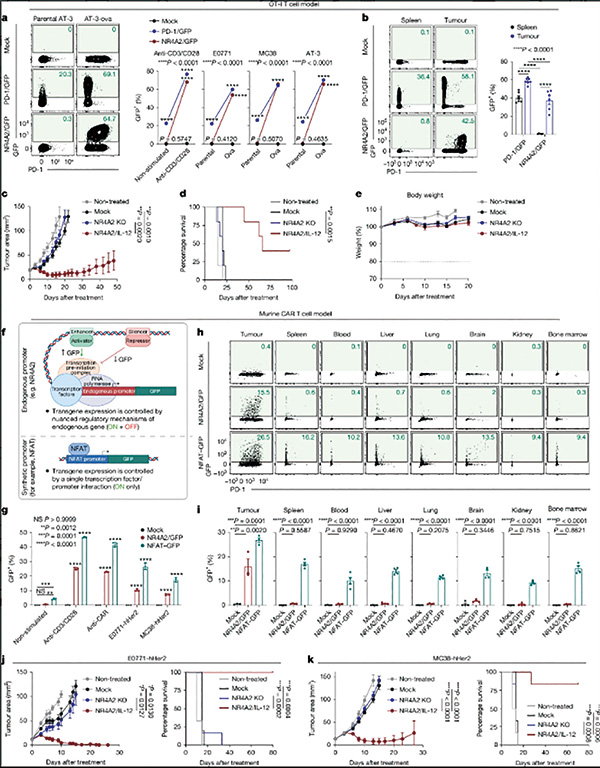
实验结果显示,携带该设计的CAR-T细胞可在多种小鼠模型中显著提高抗肿瘤活性,延长小鼠存活时间,激活内源性肿瘤免疫,改善细胞多功能性,并保持良好的安全性。这一策略同样适用于来自患者的自体CAR-T细胞,提示该策略具有较强的临床应用潜力。
研究者基于CRISPR基因编辑技术,构建了一个性能良好的启动子筛选系统。之后对比了肿瘤浸润CAR-T细胞和脾脏中CAR-T细胞的基因表达差异,发现了27个在肿瘤中显著上调表达的基因。
经过筛选,最终锁定7个基因。在经过CRISPR加持的启动子筛选系统测试后,NR4A2和RGS16两个基因胜出,尤其是NR4A2,该基因表现出严格的肿瘤限制性表达,且可让目标基因在瘤内高水平表达。
基于小鼠模型的研究结果表明,整合了NR4A2/IL-12的CAR-T细胞表现出显著增强的疗效,即使使用较低剂量也能维持这种疗效。且与对照组相比,用NR4A2/IL-12 CAR-T细胞治疗的小鼠未观察到毒性。
研究者将其设计的CAR-T细胞与传统设计方案做了比较,发现与传统方案相比,NR4A2的启动子支持更严格的肿瘤限制性转基因表达,瘤外表达水平仅有传统方案的20%左右。基于小鼠肿瘤模型的研究,也证实NR4A2的启动子更优。
不过,适合IL-12的NR4A2启动子,不太适合IL-2。NR4A2/IL-2的CAR-T细胞,控制肿瘤的能力较差。对于促炎因子IL-2而言,RGS16的启动子更优,与NR4A2/IL-2 CAR-T细胞相比,RGS16/IL-2 CAR-T细胞表现出更高的IL-2表达和优异的抗肿瘤效果,也未观察到毒性,提示RGS16启动子适合驱动IL-2等细胞因子的肿瘤内表达。
在肿瘤患者的肿瘤内,浸润T细胞的NR4A2和RGS16是否也存在特异性表达的特征。研究者在分析多个公开数据库的scRNA测序数据后发现,在多种肿瘤中,瘤内表达NR4A2和RGS16的T细胞的频率,高于外周血中的T细胞频率。提示研究者的这一设计有临床价值,且有跨瘤种治疗的潜力。
该研究率先提出了筛选瘤内特异性表达启动子的方法,为未来的相关研究提供了参考,并找到了两个能让T细胞IL-2和IL-12在瘤内特异性表达的启动子,为CAR-T细胞提供了更精准安全的递送方案,有望打破实体瘤CAR-T疗法瓶颈,有望与其他免疫疗法联合使用,提高治疗实体瘤的疗效。
(编译 张瑞轩)