国人研究开发肿瘤免疫靶点鉴定平台
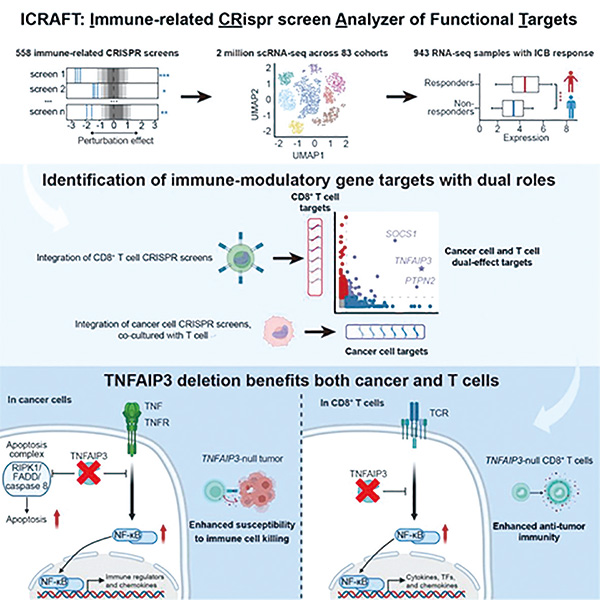
北京大学曾泽贤等研究开发了一个基于CRISPR组学的肿瘤免疫靶点鉴定平台——ICRAFT。通过整合大规模的肿瘤免疫相关的CRISPR基因编辑筛选和转录组数据,系统性揭示了能在肿瘤和免疫细胞中具有双重免疫调节作用的关键基因。因为是基于CRISPR筛选功能性数据,研究者可以鉴定有因果性的功能性基因靶点。基于这一成果,研究者进一步筛选出多个既能增强癌细胞对免疫攻击的敏感性,又能激活T细胞的潜在“双效靶点”,为提高免疫治疗的有效性、减轻治疗副作用提供了新的策略。[Immunity . 2025; 58(3): 745-765.e9.]
以往研究通常只在单一的实验条件下筛选免疫治疗靶点,难以全面解析靶点在不同免疫环境中的功能。而ICRAFT整合了来自90项研究的558个肿瘤免疫相关的CRISPR筛选数据集,首次提出CRISPR组学的概念,这些数据集涵盖了癌细胞和免疫细胞(如T细胞、B细胞、巨噬细胞等)的基因编辑结果,可以帮助研究人员了解哪些基因的缺失或激活会功能性地影响免疫反应。
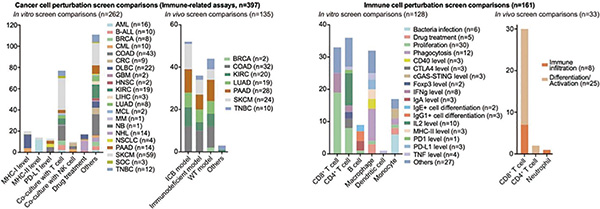
ICRAFT还包含200万单细胞RNA-Seq数据和943个免疫治疗临床样本的RNA测序数据,这些数据能让研究人员在单细胞水平上分析基因表达模式,揭示不同细胞类型在肿瘤微环境中的相互作用,并验证靶点的临床意义。
基于ICRAFT平台,研究者筛选出了多个双效靶点,并聚焦在一个关键的双效靶点TNFAIP3。TNFAIP3本身是一种泛素编辑酶,能抑制NF-κB信号通路和肿瘤坏死因子(TNF)诱导的细胞凋亡。研究者发现,在敲除癌细胞中的TNFAIP3基因后,癌细胞的免疫逃逸能力显著降低,T细胞更容易识别并杀死这些癌细胞。TNFAIP3缺失激活NF-κB信号通路,导致癌细胞分泌更多趋化因子,例如CCL5和CCL20。这些趋化因子能吸引T细胞进入肿瘤微环境。TNFAIP3缺失癌细胞对TNF诱导的细胞凋亡更敏感,进一步增强了T细胞的杀伤效果。在T细胞中敲除TNFAIP3基因同样可以获得积极好处。缺失了TNFAIP3后,T细胞表现出更强的增殖能力和细胞毒性。T细胞中与细胞毒性相关的分子,如穿孔素、颗粒酶B等的表达水平显著增加,这些分子能直接破坏癌细胞的细胞膜,诱导癌细胞凋亡。此外,T细胞能分泌更多具有肿瘤杀伤性的细胞因子,引起强烈的抗肿瘤免疫反应。机制层面的研究发现,TNFAIP3缺失所引起的免疫反应是基于TNF的,而TNF受体的缺失可回补这一现象。
除了TNFAIP3,研究者还借助ICRAFT平台找到了另外两个潜在的双重靶点PTPN2和SOCS1。这两个靶点基因的缺失同样可增强癌细胞对免疫攻击的敏感性,并提升T细胞活性。这些发现为未来联合免疫治疗策略提供了重要的理论依据和潜在靶点。研究者鉴定的TNFAIP3、PTPN2、SOCS1等双效调控因子,尤其是TNFAIP3,作为经典的自身免疫疾病相关基因,其缺失可导致NF-κB信号通路的异常激活,进而诱发免疫反应增强。
研究者提出一个科学假说:携带TNFAIP3或其他自身免疫疾病相关基因突变的个体,由于其固有的免疫反应增强特性,是否可能在肿瘤预后方面表现出优势。为验证此假说,研究者对超过31,000例癌症患者的临床数据进行了系统性分析,结果表明携带TNFAIP3变异的患者确实呈现出更为优越的生存预后,且此现象可推广至多种自身免疫疾病相关基因。
基于上述发现,研究者提出一个科学假设:尽管自身免疫反应通常被视为对人体健康的不利因素,但从另一角度而言,其可能在抑制肿瘤进展风险方面发挥积极作用。研究者也提到,该假说仍需要通过更为深入的实验和临床研究加以验证。综上,自身免疫与肿瘤发生发展机制及用药交互作用的研究,是值得深入探索的。
ICRAFT作为一个完全开源的在线分析平台(https://icraft.pku-genomics.org),不仅提供可交互式数据分析,还为科学社区提供了高质量、标准化的数据资源。作为第一个CRISPR组学的整合工具,ICRAFT可有效的鉴定具有功能性(因果性)的肿瘤免疫靶点,这将有利于加速肿瘤免疫研究和治疗策略地开发,为癌症免疫治疗的设计开辟了新的可能性。
(编译 张俊熙)